Алкины с неконцевой тройной связью служат потенциальным источником для синтеза 1,2-дикетонов при действии подходящего окислителя. Однако до сих пор не найдено универсального реагента, вызывающего окисление тройной углерод–углеродной связи до 1,2-дикарбонильной группы. Предлагавшийся для этой цели RuO 4 – оксид рутения (VIII) – слишком дорог и часто вызывает дальнейшую окислительную деструкцию 1,2-дикетонов до карбоновых кислот. При взаимодействии дизамещенных ацетиленов с такими сильными окислителями, как перманганат калия, только в совершенно нейтральной среде при рН 7–8 при 0 С окисление удается остановить на стадии образования -дикетона. Так, например, стеароловая кислота при рН 7,5 окисляется до -дикетона. В большинстве случаев окисление сопровождается расщеплением тройной связи с образованием карбоновых кислот:

Выход продуктов окислительной деструкции алкинов невелик, и эта реакция не играет заметной роли в органическом синтезе. Она используется исключительно для доказательства строения природной ацетиленовой кислоты, содержащейся в листьях тропических растений в Центральной Америке. При ее окислительной деструкции были выделены две кислоты – лауриновая и адипиновая. Это означает, что исходная кислота представляет собой 6-октадециновую кислоту с нормальным углеродным скелетом из семнадцати атомов углерода:
Гораздо более важное значение имеет окислительное сочетание алкинов-1, катализируемое солями меди (реакция Глазера–Эглинтона). В 1870 г. Глазер обнаружил, что суспензия ацетиленида меди (I), в спирте окисляется кислородом воздуха с образованием 1,3-диинов:

Для окисления ацетиленидов меди (I) в качестве окислителя более эффективен гексацианоферрат (III) калия K 3 в ДМЭ или ДМФА. В 1959 г. Эглинтон предложил значительно более удобную модификацию окислительной конденсации алкинов. Алкин окисляют ацетатом меди (II) в растворе пиридина при 60–70 С. Модификация Эглинтона оказалась чрезвычайно полезной для синтеза макроцикличеких полиинов из ,-диинов. В качестве иллюстрации приведем синтез двух циклополиинов при окислительной конденсации гексадиина-1,5 (Ф. Зондхеймер, 1960):

Один из полиинов представляет собой продукт циклотримеризации, другой – циклотетрамеризации исходного гесадиина-1,5. Тример служит исходным реагентом для синтеза ароматического -аннулена (подробнее об аннуленах см. в гл. 12). Аналогично в тех же условиях нонадиина-1,8 получается его димер – 1,3,10,12-циклооктадекатетраен наряду с тримером, тетрамером и пентамером:

Для получения несимметричных диинов используют конденсацию галогенацетиленов с алкином-1 (терминальным алкином) в присутствии солей меди (I) и первичного амина (сочетание по Кадио–Ходкевичу, 1957 г.):

Исходные бромалкины получаются при действии на алкины-1 гипобромита натрия или из ацетиленидов лития и брома:
Медьорганическое производное теминального алкина генерируют непосредственно в реакционной смеси из Cu 2 Cl 2 и алкина-1.
6.3.4. Реакции электрофильного присоединения к тройной связи
Реакции электрофильного присоединения к тройной связи относятся к числу наиболее типичных и важных реакций алкинов. В отличие от электрофильного присоединения к алкенам синтетическое применение этой большой группы реакций намного опережало развитие теоретических представлений о ее механизме. Однако за последние двадцать лет положение существенно изменилось и в настоящее время это одна из бурно развивающихся областей физической органической химии. ВЗМО алкина располагается ниже, чес ВЗМО алкена (гл. 2), и это обстоятельство предопределяет в подавляющем большинстве случаев более низкую скорость присоединения электрофильного агента к алкину по сравнению с алкеном. Другим фактором, определяющим различие в реакционной способности алкинов и алкенов в реакциях электрофильного присоединения, является относительная стабильность интермедиатов, возникающих при присоединении электрофильной частицы к тройной и двойной связям. При присоединении электрофильной частицы Н + или Е + к двойной связи образуется циклический или открытый карбокатион (гл. 5). Присоединение Н + или Е + к тройной связи приводит к образованию открытого или циклического винил-катиона. В линейном открытом винил-катионе центральный атом углерода находится в sp -гибридном состоянии, в то время как вакантная р -орбиталь ортогональна -связи. Поскольку sp -гибридный атом углерода винил-катиона обладает более высокой электроотрицательностью по сравнению с sp 2 -гибридным атомом алкил-катиона, винил-катион должен быть менее стабилен по сравнению с алкил-катионом:

Данные квантовомеханических расчетов, а также термодинамические данные для газовой фазы, полученные с помощью масс-спектрометрии высокого давления и спектроскопии циклотронного резонанса, находятся в полном соответствии с этими рассуждениями. В табл. 6.3 приведены термодинамические данные для образования ряда карбокатионов и углеводородов, относящиеся к газовой фазе при 25 С.
|
Карбокатион |
ΔН f ˚ ккал/моль |
|
| |
|
| |
|
|
Из данных, представленных в тал. 6.3, следует, что винил-катион на 47 ккал/моль менее стабилен, чем содержащий то же число атомов этил-катион. Тот же вывод можно сделать и из энтальпии ионизации в газовой фазе CH 3 CH 2 Cl и CH 2 =CHCl:
Нетрудно заметить, что сочетание обоих факторов - более высокой энергии винил-катиона и низко расположенной ВЗМО алкина - представляет более низкую реакционную способность алкинов по сравнению с алкенами в реакциях электрофильного присоединения. В табл. 6.4 собраны сравнительные данные по присоединению галогенов, сульфен- и селенилхлоридов, трифторуксусной кислоты и воды к различным алкенам и алкинам, не содержащим какой-либо активирующей или дезактивирующей функциональной группы.
Таблица 6.4
Сравнительная характеристика алкинов и алкенов
в реакциях электрофильного присоединения
|
Субстраты |
К алкен /К алкин |
|
|
Бромирование в уксусной кислоте |
СН 2 CH 2 /НССН С 4 Н 9 СН=СН 2 /С 4 Н 9 ССН С 6 Н 5 СН=СН 2 /С 6 Н 5 ССН | |
|
Хлорирование в уксусной кислоте |
С 6 Н 5 СН=СН 2 /С 6 Н 5 ССН С 4 Н 9 СН=СН 2 /С 6 Н 5 ССН С 2 Н 5 С=СНС 2 Н 5 /С 2 Н 5 ССС 2 Н 5 | |
|
Присоединение 4-хлорфенилсульфенхлорида п -ClС 6 H 4 SeCl |
СН 2 =СН 2 /НССН С 4 Н 9 СН=СН 2 /С 4 Н 9 ССН С 6 Н 5 СН=СН 2 /С 6 Н 5 ССН | |
|
Присоединение фенилселенхлорида С 6 Н 5 SeCl |
СН 2 =СН 2 /НССН С 4 Н 9 СН=СН 2 /С 4 Н 9 ССН С 6 Н 5 СН=СН 2 /С 6 Н 5 ССН | |
|
Присоединение трифторуксусной кислоты |
С 4 Н 9 СН=СН 2 /С 4 Н 9 ССН С 6 Н 5 СН=СН 2 /С 6 Н 5 ССН С 2 Н 5 СН=СН 2 /С 2 Н 5 ССН | |
|
Кислотно-катализируемая гидратация |
С 4 Н 9 СН=СН 2 /С 4 Н 9 ССН С 2 Н 5 СН=СНС 2 Н 5 /С 2 Н 5 ССС 2 Н 5 С 6 Н 5 СН=СН 2 /С 6 Н 5 ССН |
Из этих данных следует, что только присоединение кислотных агентов и воды к тройной и двойной связям происходит с близкими скоростями. Присоединение галогенов, сульфенхлоридов и ряда других реагентов к алкенам протекает в 10 2 10 5 раз быстрее, чем к алкинам. Это означает, что углеводороды, содержащие несопряженные тройную и двойную связи, избирательно присоединяют эти реагенты по двойной связи, например:

К данным по сравнительной гидратации алкинов и алкенов следует относиться с осторожностью, поскольку для гидратации алкинов требуется катализ ионами ртути (II), который неэффективен для присоединения воды к двойной связи. Поэтому данные по гидратации тройной и двойной связи, строго говоря, не сопоставимы.
Присоединение галогенов, галогеноводородов, сульфенхлоридов и других электрофильных агентов можно осуществлять ступенчато, что легко проиллюстрировать с помощью следующих примеров:



4.5. Окисление алкенов
Реакции окисления алкенов целесообразно подразделить на две большие группы: реакции, в которых сохраняется углеродный скелет и реакции окислительной деструкции углеродного скелета молекулы по двойной связи. К первой группе реакций относятся эпоксидирование, а также гидроксилирование, приводящее к образованию вицинальных диолов (гликолей). В случае циклических алкенов при гидроксилировании образуются вицинальные транс - или цис -диолы. Другая группа включает озонолиз и реакции исчерпывающего окисления алкенов, приводящие к образованию различного рода карбонильных соединений и карбоновых кислот.
4.5.а. Реакции окисления алкенов с сохранением углеродного скелета
1. Эпоксидирование (реакция Н.А. Прилежаева, 1909 г)
Ациклические и циклические алкены при взаимодействии с перкислотами (надкислотами) RCOOOH в неполярной, индифферентной среде образуют эпоксиды (оксираны), поэтому сама реакция носит название реакции эпоксидирования.
Согласно современной номенклатуре ИЮПАК - трехчленный цикл с одним атомом кислорода носит название оксиран.
Эпоксидирование алкенов следует рассматривать как синхронный, согласованный процесс, в котором не участвуют ионные интермедиаты типа гидроксильного катиона ОН+ . Другими словами, эпоксидирование алкенов представляет собой процесс син -присоединения одного атома кислорода по двойной связи с полным сохранением конфигурации заместителей при двойной связи.
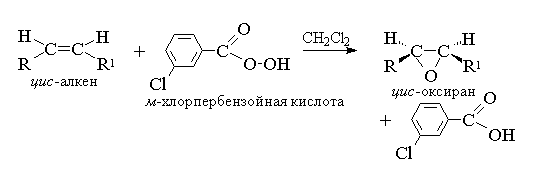

Для эпоксидирования был предложен механизм, характерный для согласованных процессов.

Т. к. атака двойной связи атомом кислорода надкислоты равновероятна с обеих сторон плоскости двойной связи, образующиеся оксираны представляют собой либо мезо -формы, либо смеси энантиомеров. В качестве эпоксидирующих агентов используются следующие перкислоты: пербензойная, м -хлорпербензойная, моноперфталевая, перуксусная, трифторперуксусная и пермуравьиная. Перкислоты ароматического ряда применяют в виде индивидуальных реагентов, тогда как перкислоты алифатического ряда - СН 3 СО 3 Н, CF 3 CO 3 H и НСО 3 Н не выделяют в индивидуальном виде, а используют после их образования при взаимодействии 30% или 90%-ного пероксида водорода и соответствующей карбоновой кислоты. Пербензойную и м -хлорпербензойную кислоты получают окислением соответственно бензойной и м -хлорбензойной кислот 70%-ной перекисью водорода в растворе метансульфокислоты или из хлорангидридов этих кислот и перекиси водорода.


Моноперфталевую кислоту получают подобным методом из фталевого ангидрида и 30%-ной перекиси водорода.

Первоначально для получения оксиранов (эпоксидов) использовались пербензойная или моноперфталевая кислоты:

В настоящее время для эпоксидирования чаще всего используют м -хлорпербензойную кислоту. В отличие от других перкислот она стабильна при хранении в течение длительного времени (до 1 года) и абсолютно безопасна при обращении. Выходы оксиранов, полученных при окислении ациклических и циклических алкенов м -хлорпербензойной кислотой в растворе хлористого метилена, хлороформа или диоксана, обычно довольно высоки.



Перкислоты часто генерируют прямо в реакционной смеси из 90% перекиси водорода и карбоновой кислоты в хлористом метилене.


Алкены с двойной связью, сопряженной с карбонильной группой или другим акцепторным заместителем, малоактивны и для их окисления лучше использовать более сильные окислители, такие как трифторперуксусная кислота, получаемая из ангидрида трифторуксусной кислоты и 90%-ной перекиси водорода в хлористом метилене. Простейший оксиран - окись этилена получают в промышленности окислением этилена кислородом в присутствии серебра, как катализатора.

2. анти -Гидроксилирование
Трехчленное кольцо оксиранов легко раскрывается под действием самых разнообразных нуклеофильных реагентов. Эти реакции подробно будут обсуждаться в разделе, посвященном ациклическим и циклическим простым эфирам. Здесь же будет рассматриваться только гидролиз оксиранов. Гидролиз оксиранов катализируется как кислотами, так и основаниями. В обоих случаях образуются вицинальные диолы, т. е. гликоли. При кислотном катализе в первой стадии происходит протонирование атома кислорода оксирана с образованием циклического оксониевого катиона, который раскрывается в результате нуклеофильной атаки молекулы воды:

Ключевой стадией в раскрытии кольца, определяющей скорость всего процесса, является нуклеофильная атака водой на протонированную форму оксирана. С точки зрения механизма этот процесс аналогичен раскрытию бромониевого иона при нуклеофильной атаке бромид-иона или другого нуклеофильного агента. С этих позиций стереохимическим результатом должно быть образование транс -гликолей при расщеплении циклических эпоксидов. Действительно, при кислотно-катализируемом гидролизе циклогексеноксида или циклопентеноксида образуются исключительно транс -1,2-диолы.

Таким образом, двухстадийный процесс эпоксидирования алкена с последующим кислотным гидролизом эпоксида суммарно соответствует реакции анти -гидроксилирования алкенов.
Обе стадии анти -гидроксилирования алкенов можно совместить, если алкен обрабатывать водной 30-70%-ной перекисью водорода в муравьиной или трифторуксусной кислоте. Обе эти кислоты являются достаточно сильными для того, чтобы вызвать раскрытие оксиранового цикла.

Раскрытие оксиранового кольца, катализируемое основанием, также приводит к образованию циклических транс -гликолей.

Следовательно, двухстадийный процесс эпоксидирования алкенов с последующим щелочным гидролизом эпоксидов также является реакцией анти -гидроксилирования алкенов.
3. син -Гидроксилирование
Некоторые соли и оксиды переходных металлов в высших степенях окисления являются эффективными реагентами син -гидроксилирования двойной связи алкена, когда обе гидроксильные группы присоединяются с одной и той же стороны двойной связи. Окисление алкенов перманганатом калия - один из старейших методов син -гидроксилирования двойной связи - продолжает широко использоваться, несмотря на свойственные ему ограничения. Цис -1,2-циклогександиол был впервые получен В.В. Марковниковым в 1878 году гидроксилированием циклогексена водным раствором перманганата калия при 0 0 С.

Этот метод в дальнейшем получил развитие в работах русского ученого Е.Е. Вагнера, поэтому син -гидроксилирование алкенов под действием водного раствора перманганата калия носит название реакции Вагнера. Перманганат калия является сильным окислителем, способным не только гидроксилировать двойную связь, но и расщеплять образующийся вицинальный диол. Для того, чтобы по возможности избежать дальнейшего расщепления гликолей, необходимо тщательно контролировать условия реакции. Выходы гликолей при этом обычно невелики (30-60%). Наилучшие результаты достигаются при гидроксилировании алкенов в слабощелочной среде (рН~8 9) при 0-5 0 С разбавленным 1%-ным водным раствором KMnO 4 .


Первоначально при окислении алкенов перманганатом калия образуется циклический эфир марганцевой кислоты, который немедленно гидролизуется до вицинального диола.

Циклический эфир марганцевой кислоты как интермедиат не был выделен, однако его образование следует из экспериментов с меченым 18 О перманганатом калия: оба атома кислорода в гликоле оказываются мечеными при окислении алкена KMn 18 O 4 . Это означает, что оба атома кислорода переходят от окислителя, а не из растворителя - воды, что находится в хорошем соответствии с предлагаемым механизмом.
Другой метод син -гидроксилирования алкенов под действием оксида осмия (VIII) OsO 4 был предложен Р. Криге в 1936 году. Тетраоксид осмия представляет собой бесцветное, летучее, кристаллическое вещество, хорошо растворимое в эфире, диоксане, пиридине и др. органических растворителях. При взаимодействии тетраоксида осмия с алкенами в эфире или диоксане образуется черный осадок циклического эфира осмиевой кислоты - осмат, который легко может быть изолирован в индивидуальном виде. Присоединение OsO 4 к двойной связи заметно ускоряется в растворе в пиридине. Разложение осматов до вицинальных гликолей достигается действием водного раствора гидросульфита натрия или сероводородом.

Выходы продуктов син -гидроксилирования алкенов в этом методе значительно выше, чем при использовании перманганата в качестве окислителя. Важным достоинством метода Криге является отсутствие продуктов окислительного расщепления алкенов, характерного для перманганатного окисления.


Тетраоксид осмия очень дорогой и труднодоступный реагент, к тому же он токсичен. Поэтому оксид осмия (VIII) используется при синтезе малых количеств трудно доступных веществ с целью получения наиболее высокого выхода диола. С целью упрощения син -гидроксилирования алкенов под действием OsO 4 была разработана методика, позволяющая использовать лишь каталитические количества этого реагента. Гидроксилирование алкенов осуществляется с помощью перекиси водорода в присутствии OsO 4 , например:

В заключение этого раздела приведем стереохимические отношения между алкеном цис - или транс -конфигурации и конфигурацией образующегося вицинального диола, который может быть цис - или транс -изомером, эритро - или трео -формой, мезо - или D,L -формой в зависимости от заместителей в алкене:

Аналогичные стереохимические отношения наблюдаются и в других реакциях син - или анти -присоединения по кратной связи водорода, галогенводородов, воды, галогенов, гидридов бора и др. реагентов.
18. Окислительно-восстановительные реакции (продолжение 2)
18.9. ОВР с участием органических веществ
В ОВР органических веществ с неорганическими органические вещества чаще всего являются восстановителями. Так, при сгорании органического вещества в избытке кислорода всегда образуется углекислый газ и вода. Сложнее протекают реакции при использовании менее активных окислителей. В этом параграфе рассмотрены только реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Алкены. При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
C 2 H 4 + 2KMnO 4 + 2H 2 O CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH (охлаждение)
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O (нагревание)
2) 5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O (нагревание)
3) CH 3 CH=CHCH 2 CH 3 + 6KMnO 4 + 10KOH CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 6K 2 MnO 4 (нагревание)
4) CH 3 CH=CH 2 + 10KMnO 4 + 13KOH CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4 (нагревание)
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
Алкины. Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алканов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH 3 C CH + 8KMnO 4 + 12H 2 SO 4 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O (нагревание)
Иногда удается выделить промежуточные продукты окисления. В зависимости от положения тройной связи в молекуле это или дикетоны (R 1 –CO–CO–R 2), или альдокетоны (R–CO–CHO).
Ацетилен может быть окислен перманганатом калия в слабощелочной среде до оксалата калия:
3C 2 H 2 + 8KMnO 4 = 3K 2 C 2 O 4 +2H 2 O + 8MnO 2 + 2KOH
В кислотной среде окисление идет до углекислого газа:
C 2 H 2 + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
Гомологи бензола. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C 6 H 5 CH 3 +2KMnO 4 = C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O (при кипячении)
C 6 H 5 CH 2 CH 3 + 4KMnO 4 = C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH (при нагревании)
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
Спирты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O (нагревание)
С избытком окислителя (KMnO 4 , K 2 Cr 2 O 7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH 2 –CH 2 OH, при нагревании в кислотной среде с раствором KMnO 4 или K 2 Cr 2 O 7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH 2 –COOH, HOOC–COOH и др.).
Альдегиды. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO 4 , K 2 Cr 2 O 7 , OH. Все реакции идут при нагревании:
3CH 3 CHO + 2KMnO 4 = CH 3 COOH + 2CH 3 COOK +
2MnO 2 + H 2 O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4
= 3CH 3 COOH + Cr 2 (SO 4) 3 + 7H 2 O
CH 3 CHO + 2OH = CH 3 COONH 4
+ 2Ag + H 2 O + 3NH 3
Формальдегид с избытком окислителя окисляется до углекислого газа.
18.10. Сравнение окислительно-восстановительной активности различных веществ
Из определений понятий " атом-окислитель" и " атом-восстановитель" следует, что только окислительными свойствами обладают атомы в высшей степени окисления. Наоборот, только восстановительными свойствами обладают атомы в низшей степени окисления. Атомы, находящиеся в промежуточных степенях окисления, могут быть как окислителями, так и восстановителями.
Вместе с тем, основываясь только на степени окисления, невозможно однозначно оценить окислительно-восстановительные свойства веществ. В качестве примера рассмотрим соединения элементов VA группы. Соединения азота(V) и сурьмы(V) являются более или менее сильными окислителями, соединения висмута(V) – очень сильные окислители, а соединения фосфора(V) окислительными свойствами практически не обладают. В этом и других подобных случаях имеет значение, насколько данная степень окисления характерна для данного элемента, то есть, насколько устойчивы соединения, содержащие атомы данного элемента в этой степени окисления.
Любая ОВР протекает в направлении образования более слабого окислителя и более слабого восстановителя. В общем случае возможность протекания какой-либо ОВР, как и любой другой реакции, может быть определена по знаку изменения энергии Гиббса. Кроме того, для количественной оценки окислительно-восстановительной активности веществ используют электрохимические характеристики окислителей и восстановителей (стандартные потенциалы окислительно-восстановительных пар). Основываясь на этих количественных характеристиках, можно построить ряды окислительно-восстановительной активности различных веществ. Известный вам ряд напряжений металлов построен именно таким образом. Этот ряд дает возможность сравнивать восстановительные свойства металлов в водных растворах, находящихся в стандартных условиях (с = 1 моль/л, Т = 298,15 К), а также окислительные свойства простых аквакатионов. Если в верхней строке этого ряда поместить ионы (окислители), а в нижней – атомы металлов (восстановители), то левая часть этого ряда (до водорода) будет выглядеть так:
В этом ряду окислительные свойства ионов (верхняя строка) усиливаются слева направо, а восстановительные свойства металлов (нижняя строка), наоборот, справа налево.
Учитывая различия в окислительно-восстановительной активности в разных средах, можно построить аналогичные ряды и для окислителей. Так, для реакций в кислотной среде (pH = 0) получается " продолжение" ряда активности металлов в направлении усиления окислительных свойств
Как и в ряду активности металлов, в этом ряду окислительные свойства окислителей (верхняя строка) усиливаются слева направо. Но, используя этот ряд, сравнивать восстановительную активность восстановителей (нижняя строка) можно только в том случае, когда их окисленная форма совпадает с приведенной в верхней строке; в этом случае она усиливается справа налево.
Рассмотрим несколько примеров. Чтобы узнать, возможна ли данная ОВР будем использовать общее правило, определяющее направление протекания окислительно-восстановительных реакций (реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя).
1. Можно ли магнием восстановить кобальт из
раствора CoSO 4 ?
Магний более сильный восстановитель, чем
кобальт, и ионы Co 2
более сильные окислители, чем ионы Mg 2 , следовательно, можно.
2. Можно ли раствором FeCl 3 окислить медь до CuCl 2
в кислотной среде?
Так как ионы Fe 3B более сильные окислители,
чем ионы Cu 2 , а медь
более сильный восстановитель, чем ионы Fe 2 , то можно.
3. Можно ли, продувая кислород через подкисленный
соляной кислотой раствор FeCl 2 , получить
раствор FeCl 3 ?
Казалось бы нет, так как в нашем ряду кислород
стоит левее ионов Fe 3
и является более слабым окислителем, чем эти
ионы. Но в водном растворе кислород практически
никогда не восстанавливается до H 2 O 2 , в
этом случае он восстанавливается до H 2 O и
занимает место между Br 2 и MnO 2 .
Следовательно такая реакция возможна, правда,
протекает она довольно медленно (почему?).
4. Можно ли в кислотной среде перманганатом калия
окислить H 2 O 2 ?
В этом случае H 2 O 2 восстановитель и
восстановитель более сильный, чем ионы Mn 2B ,
а ионы MnO 4
окислители более сильные, чем образующийся из
пероксида кислород. Следовательно, можно.
Аналогичный ряд, построенный для ОВР в щелочной среде, выглядит следующим образом:
В отличие от " кислотного" ряда, этот ряд нельзя использовать совместно с рядом активности металлов.
Метод электронно-ионного баланса (метод полуреакций), межмолекулярные ОВР, внутримолекулярные ОВР, ОВР дисмутации (диспропорционирования, самоокисления-самовосстановления), ОВР конмутации, пассивация.
- Используя метод электронно-ионого баланса, составьте уравнения реакций, протекающих при добавлении к подкисленному серной кислотой раствору перманганата калия раствора а) H 2 S {S, точнее, S 8 }; б) KHS; в) K 2 S; г) H 2 SO 3 ; д) KHSO 3 ; е) K 2 SO 3 ; ё) HNO 2 ; ж) KNO 2 ; и) KI {I 2 }; к) FeSO 4 ; л) C 2 H 5 OH {CH 3 COOH}; м) CH 3 CHO; н) (COOH) 2 {CO 2 }; п) K 2 C 2 O 4 . Здесь и далее в необходимых случаях в фигурных скобках указаны продукты окисления.
- Составьте уравнения реакций, протекающих при пропускании следующих газов через подкисленный серной кислотой раствор перманганата калия: а) C 2 H 2 {CO 2 }; б) C 2 H 4 {CO 2 }; в) C 3 H 4 (пропин) {CO 2 и CH 3 COOH}; г) C 3 H 6 ; д) CH 4 ; е) HCHO.
- То же, но раствор восстановителя добавлен к нейтральному раствору перманганата калия: а) KHS; б) K 2 S; в) KHSO 3 ; г) K 2 SO 3 ; д) KNO 2 ; е) KI.
- То же, но в раствор перманганата калия предварительно добавлен раствор гидроксида калия: а) K 2 S {K 2 SO 4 }; б) K 2 SO 3 ; в) KNO 2 ; г) KI {KIO 3 }.
- Составьте уравнения следующих реакций,
протекающих в растворе: а) KMnO 4 + H 2 S ...;
б) KMnO 4 + HCl ...;
в) KMnO 4 + HBr ...;
г) KMnO 4 + HI ... - Составьте следующие уравнения ОВР диоксида марганца:
- К подкисленному серной кислотой раствору дихромата калия добавлены растворы следующих веществ: а) KHS; б) K 2 S; в) HNO 2 ; г) KNO 2 ; д) KI; е) FeSO 4 ; ж) CH 3 CH 2 CHO; и) H 2 SO 3 ; к) KHSO 3 ; л) K 2 SO 3 . Составьте уравнения протекающих реакций.
- То же, но через раствор пропущены следующие газы: а) H 2 S; б) SO 2 .
- К раствору хромата калия, содержащему гидроксид калия, добавлены растворы а) K 2 S {K 2 SO 4 }; б) K 2 SO 3 ; в) KNO 2 ; г) KI {KIO 3 }. Составьте уравнения протекающих реакций.
- К раствору хлорида хрома(III) прибавили раствор гидроксида калия до растворения первоначально образовавшегося осадка, а затем – бромную воду. Составьте уравнения протекающих реакций.
- То же, но на последнем этапе был добавлен раствор пероксодисульфата калия K 2 S 2 O 8 , восстановивегося в процессе реакции до сульфата.
- Составьте уравнения реакций, протекающих в растворе:
- Составьте уравнения реакций, протекающих между твердым триоксидом хрома и следующими веществами: а) C; б) CO; в) S {SO 2 }; г) H 2 S; д) NH 3 ; е) C 2 H 5 OH {CO 2 и H 2 O}; ж) CH 3 COCH 3 .
- Составьте уравнения реакций, протекающих при добавлении в концентрированную азотную кислоту следующих веществ: а) S {H 2 SO 4 }; б) P 4 {(HPO 3) 4 }; в) графит; г) Se; д) I 2 {HIO 3 }; е) Ag; ж) Cu; и) Pb; к) KF; л) FeO; м) FeS; н) MgO; п) MgS; р) Fe(OH) 2 ; с) P 2 O 3 ; т) As 2 O 3 {H 3 AsO 4 }; у) As 2 S 3 ; ф) Fe(NO 3) 2 ; х) P 4 O 10 ; ц) Cu 2 S.
- То же, но при пропускании следующих газов: а) CO; б) H 2 S; в) N 2 O; г) NH 3 ; д) NO; е) H 2 Se; ж) HI.
- Одинаково, или по-разному будут протекать реакции в следующих случаях: а) в высокую пробирку на две трети заполненную концентрированной азотной кислотой, поместили кусочек магния; б) на поверхность магниевой пластины поместили каплю концентрированной азотной кислоты? Составьте уравнения реакций.
- В чем отличие реакции концентрированной азотной кислоты с сероводородной кислотой и с газообразным сероводородом? Составьте уравнения реакций.
- Одинаково ли будут протекать ОВР при добавлении к концентрированному раствору азотной кислоты безводного кристаллического сульфида натрия и его 0,1 M раствора?
- Концентрированной азотной кислотой обработали смесь следующих веществ: Cu, Fe, Zn, Si и Cr. Составьте уравнения протекающих реакций.
- Составьте уравнения реакций, протекающих при добавлении в разбавленную азотную кислоту следующих веществ: а) I 2 ; б) Mg; в) Al; г) Fe; д) FeO; е) FeS; ж) Fe(OH) 2 ; и) Fe(OH) 3 ; к) MnS; л) Cu 2 S; м) CuS; н) CuO; п) Na 2 S кр; р) Na 2 S р; с) P 4 O 10 .
- Какие процессы будут протекать при пропускании через разбавленный раствор азотной кислоты а) аммиака, б) сероводорода, в) диоксида углерода?
- Составьте уравнения реакций, протекающих при добавлении в концентрированную серную кислоту следующих веществ: а) Ag; б) Cu; в) графит; г) HCOOH; д) С 6 H 12 O 6 ; е) NaCl кр; ж) C 2 H 5 OH.
- При пропускании через холодную концентрированную серную кислоту сероводорода образуется S и SO 2 , горячая концентрированная H 2 SO 4 окисляет серу до SO 2 . Составьте уравнения реакций. Как будет протекать реакция между горячей концентрированной H 2 SO 4 и сероводородом?
- Почему хлороводород получают, обрабатывая кристаллический хлорид натрия концентрированной серной кислотой, а бромоводород и йодоводород этим способом не получают?
- Составьте уравнения реакций, протекающих при взаимодействии разбавленной серной кислоты с а) Zn, б) Al, в) Fe, г) хромом в отсутствии кислорода, д) хромом на воздухе.
- Составьте уравнения реакций, характеризующих окислительно-восстановительные свойства пероксида водорода:
- Какие реакции протекают при нагревании следующих веществ: а) (NH 4) 2 CrO 4 ; б) NaNO 3 ; в) CaCO 3 ; г) Al(NO 3) 3 ; д) Pb(NO 3) 3 ; е) AgNO 3 ; ж) Hg(NO 3) 2 ; и) Cu(NO 3) 2 ; к) CuO; л) NaClO 4 ; м) Ca(ClO 4) 2 ; н) Fe(NO 3) 2 ; п) PCl 5 ; р) MnCl 4 ; с) H 2 C 2 O 4 ; т) LiNO 3 ; у) HgO; ф) Ca(NO 3) 2 ; х) Fe(OH) 3 ; ц) CuCl 2 ; ч) KClO 3 ; ш) KClO 2 ; щ) CrO 3 ?
- При сливании горячих растворов хлорида аммония и нитрата калия протекает реакция, сопровождающаяся выделением газа. Составьте уравнение этой реакции.
- Составьте уравнения реакций, протекающих при пропускании через холодный раствор гидроксида натрия а) хлора, б) паров брома. То же, но через горячий раствор.
- При взаимодействии с горячим концентрированным раствором гидроксида калия селен подвергается дисмутации до ближайших устойчивых степеней окисления (–II и +IV). Составьте уравнение этой ОВР.
- При тех же условиях сера подвергается аналогичной дисмутации, но при этом избыток серы реагирует с сульфит-ионами с образованием тиосульфат ионов S 2 O 3 2 . Составьте уравнения протекающих реакций. ;
- Составьте уравнения реакций электролиза а) раствора нитрата меди с серебряным анодом, б) раствора нитрата свинца с медным анодом.
а) CrCl 2 + FeCl 3 ; б) CrSO 4 + FeCl 3 ; в) CrSO 4 + H 2 SO 4 + O 2 ;
г) CrSO 4 + H 2 SO 4 + MnO 2 ; д) CrSO 4 + H 2 SO 4 + KMnO 4 .
В каких из этих реакций пероксид водорода является окислителем, а в каких – восстановителем?
| Опыт 1.
Окислительные
свойства перманганата калия в кислотной среде.
K 3-4 каплям раствора перманганата калия прилить
равный объем разбавленного раствора серной
кислоты, а затем раствор сульфита натрия до
обесцвечивания. Составить уравнение реакции. Опыт 2. Окислительные свойства перманганата калия в нейтральной среде. К 3-4 каплям раствора перманганата калия прилить 5-6 капель раствора сульфита натрия. Какое вещество выделилось в виде осадка? Опыт 3 . Окислительные свойства перманганата калия в щелочной среде. К 3-4 каплям раствора перманганата калия прилить 10 капель концентрированного раствора гидроксида натрия и 2 капли раствора сульфита натрия. Раствор должен приобрести зеленую окраску. Опыт 4 . Окислительные свойства дихромата калия в кислотной среде. 6 капель раствора дихромата калия подкислить четырьмя каплями разбавленного раствора серной кислоты и добавить раствор сульфита натрия до изменения окраски смеси. Опыт 5. Окислительные свойства разбавленной серной кислоты. В одну пробирку поместить гранулу цинка, а в другую – кусочек медной ленты. В обе пробирки добавить 8-10 капель разбавленного раствора серной кислоты. Сравнить происходящие явления. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 6. Окислительные свойства концентрированной серной кислоты. Аналогично опыту 5, но добавить концентрированный раствор серной кислоты. Через минуту после начала выделения газообразных продуктов реакции ввести в пробирки полоски фильтровальной бумаги, смоченные растворами перманганата калия и сульфата меди. Объяснить происходящие явления. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 7. Окислительные свойства разбавленной азотной кислоты. Аналогично опыту 5, но добавить разбавленный раствор азотной кислоты. Наблюдать изменение цвета газообразных продуктов реакции. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 8 . Окислительные свойства концентрированной азотной кислоты. В пробирку поместить кусочек медной ленты и прилить 10 капель концентрированного раствора азотной кислоты. Осторожно нагреть до полного растворения металла. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 9 . Окислительные свойства нитрита калия. К 5-6 каплям раствора нитрита калия прилить равный объем разбавленного раствора серной кислоты и 5 капель раствора иодида калия. Образование каких веществ наблюдается? Опыт 10 . Восстановительные свойства нитрита калия. К 5-6 каплям раствора перманганата калия добавить равный объем разбавленного раствора серной кислоты и раствор нитрита калия до полного обесцвечивания смеси. Опыт 11. Термическое разложение нитрата меди. Один микрошпатель тригидрата нитрата меди поместить в пробирку, закрепить ее в штативе и осторожно нагреть открытым пламенем. Наблюдать обезвоживание и последующее разложение соли. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! Опыт 12 . Термическое разложение нитрата свинца. Провести аналогично опыту 11, поместив в пробирку нитрат свинца. ОПЫТ ПРОВОДИТЬ В ВЫТЯЖНОМ ШКАФУ! В чем отличие процессов, протекающих при разложении этих солей? |
В окислительно-восстановительных реакциях органические вещества чаще проявляют свойства восстановителей, а сами окисляются. Легкость окисления органических соединений зависит от доступности электронов при взаимодействии с окислителем. Все известные факторы, вызывающие увеличение электронной плотности в молекулах органических соединений (например, положительные индуктивный и мезомерные эффекты), будут повышать их способность к окислению и наоборот.
Склонность органических соединений к окислению возрастает с ростом их нуклеофильности , что соответствует следующим рядам:
Рост нуклеофильности в ряду
Рассмотрим окислительно-восстановительные реакции представителей важнейших классов органических веществ с некоторыми неорганическими окислителями.
Окисление алкенов
При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом:
3C 2 H 4 + 2KMnO 4 + 4H 2 O → 3CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH
В более жестких условиях окисление приводит к разрыву углеродной цепи по двойной связи и образованию двух кислот (в сильно щелочной среде – двух солей) или кислоты и диоксида углерода (в сильно щелочной среде – соли и карбоната):
1) 5CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5C 2 H 5 COOH + 8MnSO 4 + 4K 2 SO 4 + 17H 2 O
2) 5CH 3 CH=CH 2 + 10KMnO 4 + 15H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 10MnSO 4 + 5K 2 SO 4 + 20H 2 O
3) CH 3 CH=CHCH 2 CH 3 + 8KMnO 4 + 10KOH → CH 3 COOK + C 2 H 5 COOK + 6H 2 O + 8K 2 MnO 4
4) CH 3 CH=CH 2 + 10KMnO 4 + 13KOH → CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4
Дихромат калия в сернокислотной среде окисляет алкены аналогично реакциям 1 и 2.
При окислении алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, происходит образование двух кетонов:


Окисление алкинов
Алкины окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные кратной связью. В результате реакций образуются кислоты и диоксид углерода. Окисление может быть проведено перманганатом или дихроматом калия в кислотной среде, например:
5CH 3 C≡CH + 8KMnO 4 + 12H 2 SO 4 → 5CH 3 COOH + 5CO 2 + 8MnSO 4 + 4K 2 SO 4 + 12H 2 O

Ацетилен может быть окислен перманганатом калия в нейтральной среде до оксалата калия:
3CH≡CH +8KMnO 4 → 3KOOC –COOK +8MnO 2 +2КОН +2Н 2 О
В кислотной среде окисление идет до щавелевой кислоты или углекислого газа:
5CH≡CH +8KMnO 4 +12H 2 SO 4 → 5HOOC –COOH +8MnSO 4 +4К 2 SO 4 +12Н 2 О
CH≡CH + 2KMnO 4 +3H 2 SO 4 → 2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
Окисление гомологов бензола
Бензол не окисляется даже в довольно жестких условиях. Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C 6 H 5 CH 3 +2KMnO 4 → C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O
C 6 H 5 CH 2 CH 3 + 4KMnO 4 → C 6 H 5 COOK + K 2 CO 3 + 2H 2 O + 4MnO 2 + KOH
Окисление гомологов бензола дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С 6 Н 5 СН 3 +6КMnO 4 +9 H 2 SO 4 → 5С 6 Н 5 СООН+6MnSO 4 +3K 2 SO 4 + 14H 2 O
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O


Окисление спиртов
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O
С избытком окислителя (KMnO 4 , K 2 Cr 2 O 7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов.
5C 2 H 5 OH + 4KMnO 4 + 6H 2 SO 4 → 5CH 3 COOH + 4MnSO 4 + 2K 2 SO 4 + 11H 2 O
3CH 3 –CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O
Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа.

Двухатомный спирт, этиленгликоль HOCH 2 –CH 2 OH, при нагревании в кислой среде с раствором KMnO 4 или K 2 Cr 2 O 7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 +12H 2 SO 4 → 5HOOC –COOH +8MnSO 4 +4К 2 SO 4 +22Н 2 О
3СН 2 (ОН) – СН 2 (ОН) + 8КMnO 4 → 3KOOC –COOK +8MnO 2 +2КОН +8Н 2 О
Окисление альдегидов и кетонов
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO 4 , K 2 Cr 2 O 7 , OH, Cu(OH) 2 . Все реакции идут при нагревании:
3CH 3 CHO + 2KMnO 4 → CH 3 COOH + 2CH 3 COOK + 2MnO 2 + H 2 O
3CH 3 CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 → 3CH 3 COOH + Cr 2 (SO 4) 3 + 7H 2 O
CH 3 CHO + 2KMnO 4 + 3KOH → CH 3 COOK + 2K 2 MnO 4 + 2H 2 O
5CH 3 CHO + 2KMnO 4 + 3H 2 SO 4 → 5CH 3 COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O
CH 3 CHO + Br 2 + 3NaOH → CH 3 COONa + 2NaBr + 2H 2 O

реакция «серебряного зеркала»
C аммиачным раствором оксида серебра альдегиды окисляются до карбоновых кислот которые в аммиачном растворе дают соли аммония (реакция «серебрянного зеркала»):
CH 3 CH=O + 2OH → CH 3 COONH 4 + 2Ag + H 2 O + 3NH 3
CH 3 –CH=O + 2Cu(OH) 2 → CH 3 COOH + Cu 2 O + 2H 2 O
Муравьиный альдегид (формальдегид) окисляется, как правило, до углекислого газа:
5HCOH + 4KMnO 4 (изб ) + 6H 2 SO 4 → 4MnSO 4 + 2K 2 SO 4 + 5CO 2 + 11H 2 O
3СН 2 О + 2K 2 Cr 2 O 7 + 8H 2 SO 4 → 3CO 2 +2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O
HCHO + 4OH → (NH 4) 2 CO 3 + 4Ag↓ + 2H 2 O + 6NH 3
HCOH + 4Cu(OH) 2 → CO 2 + 2Cu 2 O↓+ 5H 2 O
Кетоны окисляются в жестких условия сильными окислителями с разрывом связей С-С и дают смеси кислот:

Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl 2 =CO 2 + Hg + 2HCl
HCOOH+ Cl 2 = CO 2 +2HCl
HOOC-COOH+ Cl 2 =2CO 2 +2HCl
Муравьиная кислота , кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается:
HCOOH →(t) CO + H2O
Каталитическое окисление алканов:

Каталитическое окисление алкенов:

Окисление фенолов:


Окислительно-восстановительные реакции с участием органических веществ
Склонность органических соединений к окислению связывают с наличием кратных связей, функциональных групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Последовательное окисление органических веществ можно представить в виде следующей цепочки превращений:
Насыщенный углеводород→ Ненасыщенный углеводород → Спирт→ Альдегид (кетон) → Карбоновая кислота →CO 2 + H 2 O
Генетическая связь между классами органических соединений представляется здесь как ряд окислительно – восстановительных реакций, обеспечивающих переход от одного класса органических соединений к другому. Завершают его продукты полного окисления (горения) любого из представителей классов органических соединений.
Зависимость окислительно-восстановительной способности органического вещества от его строения:
Повышенная склонность органических соединений к окислению обусловлена наличием в молекуле веществ:
- кратных связей (именно поэтому так легко окисляются алкены, алкины, алкадиены);
- определенных функциональных групп , способных легко окисляться (–-SH, –OH (фенольной и спиртовой), – NH 2 ;
- активированных алкильных групп , расположенных по соседству с кратными связями. Например, пропен может быть окислен до непредельного альдегида акролеина кислородом воздуха в присутствии водяных паров на висмут- молибденовых катализаторах.
H 2 C═CH−CH 3 → H 2 C═CH−COH
А также окисление толуола до бензойной кислоты перманганатом калия в кислой среде.
5C 6 H 5 CH 3 +6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 +14H 2 O
- наличие атомов водорода при атоме углерода, содержащем функциональную группу .
Примером является реакционная способность в реакциях окисления первичных, вторичных и третичных спиртов по реакционной способности к окислению.
Несмотря на то, что в ходе любых окислительно-восстановительных реакций происходит как окисление, так и восстановление, реакции классифицируют в зависимости от того, что происходит непосредственно с органическим соединением (если оно окисляется, говорят о процессе окисления, если восстанавливается – о процессе восстановления).
Так, в реакции этилена с перманганатом калия этилен будет окисляться, а перманганат калия – восстанавливается. Реакцию называют окислением этилена.
Применение понятия «степени окисления» (СО) в органической химии очень ограничено и реализуется, прежде всего, при составлении уравнений окислительно-восстановительных реакций. Однако, учитывая, что более или менее постоянной состав продуктов реакции возможен только при полном окислении (горении) органических веществ, целесообразность расстановки коэффициентов в реакциях неполного окисления отпадает. По этой причине обычно ограничиваются составлением схемы превращений органических соединений.
При изучении сравнительной характеристики неорганических и органических соединений мы знакомились с использованием степени окисления (с.о.) (в органической химии, прежде всего углерода) и способами ее определения:
1) вычисление средней с.о. углерода в молекуле органического вещества:
-8/3 +1
Такой подход оправдан, если в ходе реакции в органическом веществе разрушаются все химические связи (горение, полное разложение).
2) определение с.о. каждого атома углерода:
В этом случае степень окисления любого атома углерода в органическом соединении равна алгебраической сумме чисел всех связей с атомами более электроотрицательных элементов, учитываемых со знаком «+» у атома углерода, и числа связей с атомами водорода (или другого более электроположительного элемента), учитываемых со знаком «-» у атома углерода. При этом связи с соседними атомами углерода не учитывают.
В качестве простейшего примера определим степень окисления углерода в молекуле метанола.
![]()
Атом углерода связан с тремя атомами водорода (эти связи учитываются со знаком « – »), одной связью – с атомом кислорода (ее учитывают со знаком «+»). Получаем: -3 + 1 = -2.Таким образом, степень окисления углерода в метаноле равна -2.
Вычисленная степень окисления углерода хотя и условное значение, но оно указывает на характер смещения электронной плотности в молекуле, а ее изменение в результате реакции свидетельствует об имеющем место окислительно-восстановительном процессе.
Уточняем, в каких случаях лучше использовать тот или иной способ.
Процессы окисления, горения, галогенирования, нитрования, дегидрирования, разложения относятся к окислительно-восстановительным процессам.
При переходе от одного класса органических соединений к другому и увеличения степени разветвленности углеродного скелета молекул соединений внутри отдельного класса степень окисления атома углерода, ответственного за восстанавливающую способность соединения, изменяется.
Органические вещества, в молекулах которых содержатся атомы углерода с максимальными (- и +) значениями СО (-4, -3, +2, +3), вступают в реакцию полного окисления-горения, но устойчивых к воздействию мягких окислителей и окислителей средней силы .
Вещества, в молекулах которых содержится атомы углерода в СО -1; 0; +1, окисляются легко, восстановительные способности их близки, поэту их неполное окисление может быть достигнуто за счет одного из известных окислителей малой и средней силы . Эти вещества могут проявлять двойственную природу, выступая и в качестве окислителя , подобно тому, как это присуще неорганическим веществам.
При написании уравнений реакций горения и разложения органических веществ лучше использовать среднее значение с.о. углерода.
Например:
![]()
Составим полное уравнение химической реакции методом баланса.
Среднее значение степени окисления углерода в н-бутане:
Степень окисления углерода в оксиде углерода(IV) равна +4.
Составим схему электронного баланса:

Обратите внимание на первую половину электронного баланса: у атома углерода в дробном значении с.о. знаменатель равен 4, поэтому расчет передачи электронов ведем по этому коэффициенту.
Т.е. переход от -2,5 до +4 соответствует переходу 2,5 + 4 = 6,5 единиц. Т.к. участвует 4 атома углерода, то 6,5 · 4 = 26 электронов будет отдано суммарно атомами углерода бутана.
C учетом найденных коэффициентов уравнение химической реакции горения н-бутана будет выглядеть следующим образом:
Можно воспользоваться методом определения суммарного заряда атомов углерода в молекуле:
(4 C ) -10 …… → (1 C ) +4 , учитывая, что количество атомов до знака = и после должно быть одинаково, уравниваем (4 C ) -10 …… →[(1 C ) +4 ] · 4
Следовательно, переход от -10 до +16 связан с потерей 26 электронов.
В остальных случаях определяем значения с.о. каждого атома углерода в соединении, обращая при этом внимание на последовательность замещения атомов водорода у первичных, вторичных, третичных атомов углерода:


Вначале протекает процесс замещения у третичных, затем – у вторичных, и, в последнюю очередь – у первичных атомов углерода.
Алкены
Процессы окисления зависят от строения алкена и среды протекания реакции.
1.При окислении алкенов концентрированным раствором перманганата калия KMnO 4 в кислой среде (жесткое окисление) происходит разрыв σ- и π-связей с образованием карбоновых кислот, кетонов и оксида углерода(IV). Эта реакция используется для определения положения двойной связи.
а) Если двойная связь находится на конце молекулы (например, у бутена-1), то одним из продуктов окисления является муравьиная кислота, легко окисляющаяся до углекислого газа и воды:

б) Если в молекуле алкена атом углерода при двойной связи содержит два углеродных заместителя (например, в молекуле 2-метилбутена-2), то при его окислении происходит образование кетона , т. к. превращение такого атома в атом карбоксильной группы невозможно без разрыва C–C-связи, относительно устойчивой в этих условиях:

в) Если молекула алкена симметрична и двойная связь содержится в середине молекулы, то при окислении образуется только одна кислота:

Особенностью окисления алкенов, в которых атомы углерода при двойной связи содержат по два углеродных радикала, является образование двух кетонов:


2.В нейтральной или слабощелочной средах окисление сопровождается образованием диолов (двухатомных спиртов) , причем гидроксильные группы присоединяются к тем атомам углерода, между которыми существовала двойная связь:

В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO 4 . Поэтому она используется как качественная реакция на алкены (реакция Вагнера).
3. Окисление алкенов в присутствии солей палладия (Вакер-процесс) приводит к образованию альдегидов и кетонов:
2CH 2 =CH 2 + O 2 PdCl2/H2O → 2 CH 3 -CO-H
Гомологи окисляются по менее гидрированному атому углерода:
СH 3 -CH 2 -CH=CH 2 + 1/2O 2 PdCl2/H2O → CH 3 - CH 2 -CO-CH 3
Алкины
Окисление ацетилена и его гомологов протекает в зависимости от того, в какой среде протекает процесс.
а) В кислой среде процесс окисления сопровождается образованием карбоновых кислот:

Реакция используется для определения строения алкинов по продуктам окисления:

В нейтральной и слабощелочной средах окисление ацетилена сопровождается образованием соответствующих оксалатов (солей щавелевой кислоты), а окисление гомологов – разрывом тройной связи и образованием солей карбоновых кислот:

Для ацетилена:
1) В кислой среде:
H-C≡C-H KMnO 4, H 2 SO 4 → HOOC-COOH (щавелевая кислота)
3CH≡CH +8KMnO 4 H 2 O → 3KOOC-COOK оксалат калия +8MnO 2 ↓+ 2KOH+ 2H 2 O
Арены
(бензол и его гомологи)
При окисления аренов в кислой среде следует ожидать образования кислот, а в щелочной – солей.
Гомологи бензола с одной боковой цепью (независимо от ее длины) окисляются сильным окислителем до бензойной кислоты по α -углеродному атому. Гомологи бензола при нагревании окисляются перманганатом калия в нейтральной среде с образованием калиевых солей ароматических кислот.
5C 6 H 5 –CH 3 + 6KMnO 4 + 9H 2 SO 4 = 5C 6 H 5 COOH + 6MnSO 4 + 3K 2 SO 4 + 14H 2 O,
5C 6 H 5 –C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 = 5C 6 H 5 COOH + 5CO 2 + 12MnSO 4 + 6K 2 SO 4 + 28H 2 O,
C 6 H 5 –CH 3 + 2KMnO 4 = C 6 H 5 COOK + 2MnO 2 + KOH + H 2 O.
Подчеркиваем, что если в молекуле арена несколько боковых цепей, то в кислой среде каждая из них окисляется по a-углеродному атому до карбоксильной группы, в результате чего образуются многоосновные ароматические кислоты:

1) В кислой среде:
С 6 H 5 -CH 2 -R KMnO 4, H 2 SO 4 → С 6 H 5 -COOH бензойная кислота + CO 2
2) В нейтральной или щелочной среде:
С 6 H 5 -CH 2 -R KMnO4, H2O/(OH) → С 6 H 5 -COOK + CO 2
3) Окисление гомологов бензола перманганатом калия или бихроматом калия при нагревании:
С 6 H 5 -CH 2 -R KMnO 4, H 2 SO 4, t ˚ C → С 6 H 5 -COOH бензойная кислота + R-COOH
4) Окисление кумола кислородом в присутствии катализатора (кумольный способ получения фенола):
C 6 H 5 CH(CH 3) 2 O2, H2SO4 → C 6 H 5 -OH фенол + CH 3 -CO-CH 3 ацетон
5C 6 H 5 CH(CH 3) 2 + 18KMnO 4 + 27H 2 SO 4 → 5C 6 H 5 COOH + 42H 2 O + 18MnSO 4 + 10CO 2 + K 2 SO 4
C 6 H 5 CH(CH 3) 2 + 6H 2 O – 18ē → C 6 H 5 COOH + 2CO 2 + 18H + | x 5
MnO 4 - + 8H + + 5ē → Mn +2 + 4H 2 O | x 18
Следует обратить внимание на то, что при мягком окислении стирола перманганатом калия КMnO 4 в нейтральной или слабощелочной среде происходит разрыв π -связи,образуется гликоль (двухатомный спирт). В результате реакции окрашенный раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV).
Окисление же сильным окислителем – перманганатом калия в кислой среде – приводит к полному разрыву двойной связи и образованию углекислого газа и бензойной кислоты, раствор при этом обесцвечивается.
C 6 H 5 −CH═CH 2 + 2 KMnO 4 + 3 H 2 SO 4 → C 6 H 5 −COOH + CO 2 + K 2 SO 4 + 2 MnSO 4 +4 H 2 O
Спирты
Следует помнить, что:
1) первичные спирты окисляются до альдегидов:
3CH 3 –CH 2 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –CHO + K 2 SO 4 + Cr 2 (SO 4) 3 + 7H 2 O;
2) вторичные спирты окисляются до кетонов:

3) для третичных спиртов реакция окисления не характерна.
Третичные спирты, в молекулах которых нет атома водорода при атоме углерода, содержащем группу ОН, в обычных условиях не окисляются. В жестких условиях (при действии сильных окислителей и при высоких температурах) они могут быть окислены до смеси низкомолекулярных карбоновых кислот, т.е. происходит деструкция углеродного скелета.
При окислении метанола подкисленным раствором перманганата калия или дихромата калия образуется CO 2 .
Первичные спирты при окислении в зависимости от условий протекания реакции могут образовать не только альдегиды, но и кислоты.
Например, окисление этанола дихроматом калия на холоду заканчивается oбразованием уксусной кислоты, а при нагревании – ацетальдегида:
3CH 3 –CH 2 OH + 2K 2 Cr 2 O 7 + 8H 2 SO 4 = 3CH 3 –COOH + 2K 2 SO 4 + 2Cr 2 (SO 4) 3 + 11H 2 O,
Если три или более ОН-групп связаны с соседними атомами углерода, то при окислении иодной кислотой средний или средние атомы превращаются в муравьиную кислоту
Окисление гликолей перманганатом калия в кислой среде проходит аналогично окислительному расщеплению алкенов и также приводит к образованию кислот или кетонов в зависимости от строения исходного гликоля.
Альдегиды и кетоны
Альдегиды легче, чем спирты, окисляются в соответствующие карбоновые кислоты не только под действием сильных окислителей (кислород воздуха, подкисленные растворы KMnO 4 и K 2 Cr 2 O 7), но и под действием слабых (аммиачный раствор оксида серебра или гидроксида меди(II)):
5CH 3 –CHO + 2KMnO 4 + 3H 2 SO 4 = 5CH 3 –COOH + 2MnSO 4 + K 2 SO 4 + 3H 2 O,
3CH 3 –CHO + K 2 Cr 2 O 7 + 4H 2 SO 4 = 3CH 3 –COOH + Cr 2 (SO 4) 3 + K 2 SO 4 + 4H 2 O,
CH 3 –CHO + 2OH CH 3 –COONH 4 + 2Ag + 3NH 3 + H 2 O
Особое внимание!!! Окисление метаналя аммиачным раствором оксида серебра приводит к образованию карбоната аммония, а не муравьиной кислоты:
HCH О + 4OH = (NH 4) 2 CO 3 + 4Ag + 6NH 3 + 2H 2 O.
Для составления уравнений окислительно- восстановительных реакций используют как метод электронного баланса, так и метод полуреакций (электронно-ионный метод).
Для органической химии важна не степень окисления атома, а смещение электронной плотности, в результате которого на атомах появляются частичные заряды, никак не согласующиеся со значениями степеней окисления.
Многие вузы включают в билеты для вступительных экзаменов задания по подбору коэффициентов в уравнениях ОВР ионно-электронным методом (методом полуреакций). Если в школе и уделяется хоть какое-то внимание этому методу, то, в основном при окислении неорганических веществ.
Попробуем применить метод полуреакций для окисления сахарозы перманганатом калия в кислой среде.
Преимущество этого метода заключается в том, что нет необходимости сразу угадывать и записывать продукты реакции. Они достаточно легко определяются в ходе уравнения. Окислитель в кислой среде наиболее полно проявляет свои окислительные свойства, например, анион MnO - превращается в катион Mn 2+ , легко окисляющиеся органические соединения окисляются до CO 2 .
Запишем в молекулярном виде превращения сахарозы:
![]()
В левой части не хватает 13 атомов кислорода, чтобы устранить это противоречие, прибавим 13 молекул H 2 O.
Левая часть теперь содержит 48 атомов водорода, они выделяются в виде катионов Н + :
Теперь уравняем суммарные заряды справа и слева:
Схема полуреакций готова. Составление схемы второй полуреакции обычно не вызывает затруднений:
Объединим обе схемы:
![]()
Задание для самостоятельной работы:
Закончите УХР и расставьте коэффициенты методом электронного баланса или методом полуреакций:
CH 3 -CH=CH-CH 3 + KMnO 4 + H 2 SO 4 →
CH 3 -CH=CH-CH 3 + KMnO 4 + H 2 О →
(CH 3) 2 C=C-CH 3 + KMnO 4 + H 2 SO 4 →
CH 3 -CH 2 -CH=CH 2 + KMnO 4 + H 2 SO 4 →
С H 3 -CH 2 -C≡C-CH 3 + KMnO 4 + H 2 SO 4 →
C 6 H 5 -CH 3 + KMnO 4 + H2O →
C 6 H 5 -C 2 H 5 + KMnO 4 + H 2 SO 4 →
C 6 H 5 - CH 3 + KMnO 4 + H 2 SO 4 →
Мои заметки:
Особое внимание учащихся следует обратить на поведение окислителя – перманганата калия КМnО 4 в различных средах. Это связано с тем, что окислительно-восстановительные ре акции в КИМах встречаются не только в заданиях С1 и С2. В заданиях СЗ, представляющих цепочку превращений органических веществ нередки уравнения окисления-восстановления. В школе часто окислитель записывают над стрелкой как [О]. Требованием к выполнению таких заданий на ЕГЭ является обязательное обозначение всех исходных веществ и продуктов реак ции с расстановкой необходимых коэффициентов.
